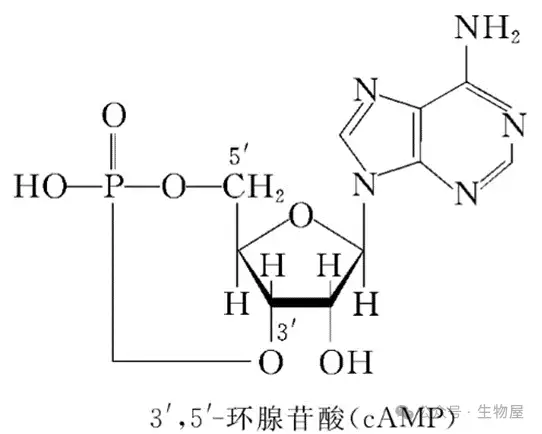
cAMP(环状腺苷酸,Cyclic Adenosine 3’, 5’-monophosphate)作为细胞内最古老且功能最为多样的第二信使之一,在细胞信号传导领域扮演着至关重要的角色。自其发现以来,cAMP不仅为第二信使的概念提供了范式,也揭示了信号区隔(signal compartmentalization)的精妙机制。细胞外的众多信号,从激素到神经递质,通过与细胞膜上的受体相互作用,最终在细胞内转化为cAMP浓度的变化,进而启动复杂的下游信号级联反应。这一过程的精妙调控确保了细胞对外界环境的精确感知和适当响应,涵盖了从基因表达调控到细胞代谢、从免疫反应到神经信号传递的广泛生理活动。cAMP信号通路的普遍存在和多样性使其成为生物医学研究的重要领域,其研究成果不仅深化了我们对细胞信号传导机制的理解,也为多种疾病的治疗策略提供了理论基础和潜在靶点。本文将系统探讨cAMP信号通路的结构基础、调控机制及其在各种生理和病理状态下的功能表现,旨在呈现一个全面而深入的视角,以期为相关领域的研究和临床应用提供参考。
02cAMP信号通路的分子基础
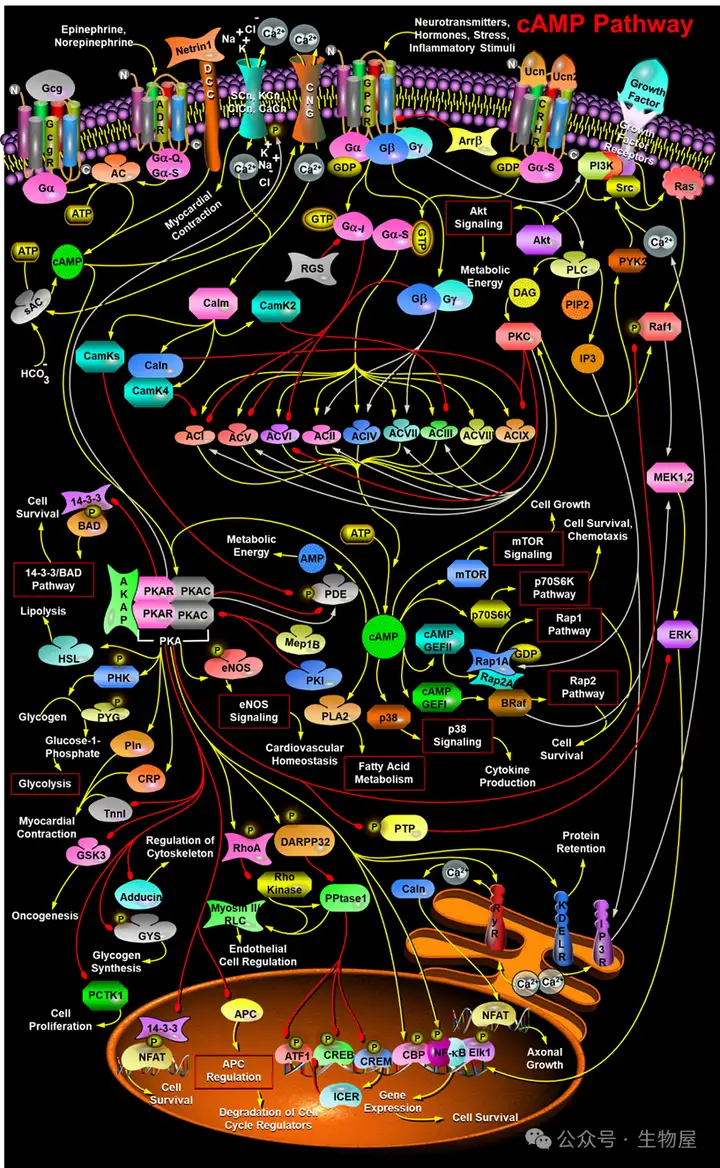
cAMP信号通路的核心在于其独特的分子组成和精确的调控机制,这一通路的起点是ATP(三磷酸腺苷)向cAMP的转化过程,这一反应由特定的酶类催化完成。在哺乳动物体内,ATP向cAMP的转化主要由III类腺苷酸环化酶(Adenylate Cyclase,AC)/腺苷酸环化酶(ADCY)家族成员介导,这些酶在人类中共有9种跨膜型AC(tmAC)和1种可溶性AC(sAC)。这种多样化的AC家族为细胞提供了精细调控cAMP水平的分子基础,使得不同类型的细胞能够根据特定的生理需求和环境信号调整其cAMP信号通路的活性。特别值得注意的是,sAC主要存在于成熟的精子中,而tmAC则广泛分布于各类细胞中,这种分布差异反映了cAMP信号通路在不同细胞类型中的特殊功能和调控机制。
tmAC和sAC在调控机制上存在显著差异,tmAC主要通过异源三聚体G蛋白(G protein)调控,对各种类型的G蛋白偶联受体(G protein-coupled receptor,GPCR)的刺激作出响应,因此在细胞对外部信号的反应中起着关键作用。相比之下,sAC不依赖G蛋白,而是直接被Ca2+和代谢物HCO3-激活,这使其成为细胞内重要的代谢传感器。这种差异化的调控机制确保了cAMP信号通路能够根据不同的细胞状态和外界刺激产生特定的反应,为细胞提供多样化的信号传导途径。
深入研究cAMP信号通路的分子基础,我们发现其复杂性远超表面理解。tmAC家族中的不同成员(I至IX)在分布、调控特性和功能上存在显著差异,例如,ACI、V、VI和IX亚型在脊柱疼痛传递中发挥重要作用,并在慢性阿片中上调,因此经常被Ca2+和其他作用于cAMP信号下游的蛋白质抑制。这种选择性的上调机制反映了cAMP信号通路在特定生理条件下如何调整其活性,以满足特定的生理需求。同时,G蛋白对ACs的调控也呈现出高度特异性,不同的G蛋白亚型对不同的AC亚型产生不同的影响。例如,Gn-αs和Gn-αq激活ACs增加细胞内cAMP水平,而Gn-αi则通过抑制ACs降低细胞内cAMP水平。此外,β和γ亚基与特定的AC亚型存在相互作用,这种复杂调控网络确保了cAMP信号的精确调控。
G蛋白信号调节因子(RGS)在cAMP信号通路中扮演着重要的调节角色,RGS蛋白能够抵消Gn-αi的活性,从而影响cAMP水平的调控。这种负反馈机制是细胞内信号传导网络的重要组成部分,有助于维持信号通路的动态平衡,防止信号过度放大或持续激活。此外,β-阻遏蛋白(β-arrestin)不仅使许多GPCR脱敏,还通过募集PDE4D(cAMP特异性磷酸二酯酶-4D)亚型,将信号从Gn-αs转换为Gn-αi,从而精细调控细胞内cAMP水平,这种机制在维持信号精确性和防止过度刺激方面发挥着关键作用。
cAMP信号通路与细胞内其他信号通路的交叉对话是其复杂性的重要体现,生长因子和PI3K(磷脂酰肌醇-3激酶)通过激活Akt与cAMP信号相互作用,进而激活PDE,促进cAMP通过Akt信号转化为AMP。这种相互作用调节了心脏的收缩力和代谢能量的释放,展示了不同信号通路如何协同工作以实现特定的生理功能。G蛋白通过激活PI3K和PLC间接影响cAMP信号传导,形成复杂的信号网络。PLC裂解PIP2生成DAG和IP3,DAG激活PKC,而IP3则通过IP3R释放Ca2+,调节cAMP信号上游的蛋白,促进Src和PYK2的激活。这种信号通路的交叉对话大大增加了细胞信号传导的复杂性和精细度,使细胞能够对外部刺激作出更为精细和协调的反应。
PKC通过激活Raf1、PYK2和ACs(如ACI、II、III、V和VII)来调节cAMP信号,但抑制ACVI,展示了这种调控的复杂性和特异性。这种选择性的激活或抑制机制确保了cAMP信号通路能够根据特定的生理需求产生不同的反应,为细胞提供了精细调控的手段。此外,Raf1促进MEK1/2的激活,进而激活ERKs,最终诱导转录调节剂Elk1介导的基因表达,展示了cAMP信号通路如何影响基因表达,进而调节细胞的长期行为和功能。这种多层次的调控机制是cAMP信号通路功能多样性的基础,也是其在众多生理过程中发挥重要作用的关键所在。
cAMP信号通路的分子基础还包括其与细胞内其他分子的相互作用和调控,例如,cAMP被发现能够激活EPACs(cAMP激活的交换蛋白),促进Rap1的激活,进而影响细胞的多种功能,如树突棘的形成和突触可塑性。这种机制在神经元中尤为重要,为学习和记忆的形成提供了分子基础。此外,cAMP还能够激活mTOR和p70S6K,促进细胞生长,同时增强PLA2的活性,促进储存能量的释放,这种双管齐下的调控机制使cAMP在细胞代谢和生长方面发挥着关键作用。Urocortin-cAMP途径能够诱导PKC和p38的激活,导致凋亡和细胞因子(如IL-6)的产生,展示了cAMP在免疫反应和炎症过程中的复杂角色。
03cAMP信号通路的主要靶点
cAMP信号通路通过激活多种下游靶点,将细胞外信号转化为特定的细胞反应。这些靶点包括蛋白激酶A(PKA)、EPACs(cAMP激活的交换蛋白)、环核苷酸门控离子通道(CNG)以及各种磷酸二酯酶(PDE),这些分子接收cAMP信号并启动不同的细胞过程,从离子通道调节到基因表达,构成了cAMP信号通路下游复杂而多样的效应网络。理解这些靶点的功能和相互作用对于揭示cAMP信号通路如何调控细胞行为具有重要意义。
·蛋白激酶A(PKA)是cAMP最主要的下游效应器,也是cAMP信号通路的主要"读出"分子。PKA是一种丝氨酸/苏氨酸蛋白激酶,其活性受到cAMP的严格调控。在没有cAMP的情况下,PKA的催化亚基与调节亚基结合,处于无活性状态。当cAMP水平升高时,cAMP与调节亚基结合,导致催化亚基的释放和激活。激活的PKA随后磷酸化各种底物,影响细胞的多种功能,从代谢调节到基因表达。值得注意的是,PKA被一种叫做AKAPs(A-激酶锚定蛋白)的蛋白质拴在特定的细胞位置上,这种锚定机制确保了PKA在特定的亚细胞区域发挥作用,从而实现了信号的区域特异性。AKAP靶向PKA同工酶对于多种生理过程非常重要,如cAMP对神经系统离子通道的调节,涉及微管动力学的细胞周期调节,染色质凝聚和去凝聚,核膜的拆卸和重组,甾体形成,生殖功能,免疫反应和许多细胞内运输机制。
·EPACs(cAMP激活的交换蛋白)是近年来发现的cAMP新靶点,它们通过Rap1/Rap2小G蛋白调控多种细胞功能,cAMP通过PKA-independent和EPAC-dependent途径激活Rap1A和Rap1B。具体而言,cAMP激活cAMP-GEFI/EPAC1和cAMP-GEFI/EPAC2,分别激活Rap1A和Rap1B。激活的Rap1A和Rap1B与BRaf形成活性复合物,激活MEK1/2,最终导致Elk1激活,Rap1A和Rap1B进一步刺激对细胞存活至关重要的Rap1和Rap2通路。在神经元中,cAMP通过EPACs激活Rap1,从而促进树突棘的形成和突触可塑性,这对于学习和记忆的形成具有重要意义。
·环核苷酸门控离子通道(CNG)是cAMP的另一重要靶点,cAMP激活CNG为Ca2+内流提供通道,这种钙离子内流对于细胞的各种功能至关重要,从神经传递到基因表达。在视网膜光感受器中,CNG通道参与光转导过程,而在嗅觉和味觉感受器中,它们则参与气味和味道的感知。此外,CNG通道还参与调节血管平滑肌的收缩和心肌细胞的兴奋-收缩偶联,展示了cAMP信号通路在多种生理过程中的作用。
·除了CNG、PKC和EPACs外,cAMP的其他直接靶点包括PDE、mTOR、p70S6K/RPS6KB1、PLA2等。cAMP激活的mTOR和p70S6K通过mTOR和p70S6K信号通路促进细胞生长,而PLA2通过增强脂肪酸代谢过程促进储存能量的释放。Urocortin-cAMP介导的PKC和p38的诱导导致凋亡和细胞因子(如IL-6)的产生,下游的Urocortin-cAMP途径在免疫反应和炎症过程中发挥重要作用。在免疫细胞中,cAMP通过调节mTOR和p70S6K的活性,影响细胞的生长和代谢,这种调控对于免疫系统的正常功能至关重要。
PKA作为cAMP的主要效应器,调控多种下游靶点,影响广泛的细胞功能。
·在心肌细胞中,cAMP-PKA的ADR-α/β刺激使几种与兴奋-收缩偶联相关的蛋白磷酸化,如L型CaCn、KCn、SCn、ClCn、RyR、Pln、CRP的激活,但抑制TnnI。PKA磷酸化调节SERCA2活性的Pln,导致Ca2+、Cl-、K+、Na+的再摄取增加,这一过程在衰竭的心脏中受到影响。Ca2+摄取激活Caln,这进一步促进NFAT转运到细胞核,这是一个对轴突生长非常重要的过程。cAMP通过控制心肌收缩过程,在调节心血管功能中起重要作用。Ca2+浓度的升高和PKA的激活通过丝氨酸残基(Ser635)的磷酸化增强eNOS酶的活性,从而刺激eNOS信号传导,这对维持心血管稳态至关重要。
·在神经元中,cAMP-PKA信号通路通过多种机制影响神经递质释放和突触可塑性。AKAPs将PKA锚定在特定位置,如树突棘和轴突始段,以精确控制神经递质释放和突触可塑性。PKA通过磷酸化特定的PPtase1抑制剂,如DARPP32来控制磷酸酶活性,当DARPP32在Thr-34位点磷酸化时,神经递质通过GPCR增强了DARPP32的相互作用,从而抑制了PPtase1的活性。这种磷酸化是CREB、CREM和ATF1转录激活的关键事件,因为它允许与转录共激活因子CBP和p300相互作用。CREM基因编码许多不同的异构体,其中一些具有抑制功能。特别是阻遏因子ICER,通过与CREB和CREM激活因子结合DNA结合位点竞争,参与cAMP诱导的转录下调。PPtase1检查磷酸化事件,以使ICER等抑制因子异构体的形成失活,从而使CREB、CREM和ATF1能够与CBP和p300等共激活因子相互作用。因此,在生理条件下,ICER诱导是一种短暂的现象,它允许cAMP信号返回到基础状态。相反,长时间或不适当的ICER诱导会引起病理后果。
·PKA还通过磷酸化特定的转录因子,影响基因表达。PKA对NK-κB的磷酸化是转录激活和与CBP相互作用所必需的,PKA调节转录因子的活性,如核受体和含有HMG的蛋白质,影响它们的二聚化或DNA结合特性。一个特殊的例子是PKA在Hedgehog信号的影响下调控Gli3的机制,Gli3的功能与果蝇基因CI活性相似。在这种情况下,磷酸化刺激Gli3的特异性切割,将蛋白质从激活因子转化为抑制因子。这种调控机制在发育过程中尤为重要,参与调控细胞命运决定和组织形态发生。
·在炎症反应中,cAMP-PKA信号通路通过多种机制抑制炎症过程。升高cAMP水平通过PKA依赖机制使GSK3Alpha和GSK3Beta失活,从而促进神经细胞的存活,从而防止肿瘤发生和神经退行性变。在炎症反应中,cAMP通过抑制GSK3,保护神经元免受淀粉样蛋白的毒性作用,这在阿尔茨海默病中尤为重要。此外,cAMP通过失活Rho激酶,抑制细胞收缩,从而减轻组织损伤。在激素的刺激下,cAMP增加RhoA的磷酸化,使Rho激酶失活。Rho激酶通过抑制Myosin磷酸酶调控亚基PPtase1的催化活性,催化其磷酸化,从而间接增加RLC磷酸化,从而调控Myosin-II和细胞收缩,Rho激酶的失活也会直接增加RLC的磷酸化。这种增加的细胞内cAMP和PKA对RLC磷酸化的激活减少了凝血酶诱导的内皮细胞等长张力的发展,从而减少了水肿的发展,这是急性和慢性炎症的标志。
04cAMP信号通路在特定生理过程中的作用
cAMP信号通路在众多生理过程中发挥着关键作用,从心脏功能到神经元信号传递,从免疫反应到代谢调节。这一信号通路的多样性使其成为细胞感知和响应外部环境的重要媒介,通过精确调控各种生理过程,维持机体的正常功能和稳态。接下来将详细探讨cAMP信号通路在特定生理过程中的作用,揭示其在维持生命活动中的核心地位。
·在心血管系统中,cAMP信号通路通过调节PKA的活性,控制心肌收缩力和心率。具体而言,cAMP-PKA的ADR-α/β刺激使几种与兴奋-收缩偶联相关的蛋白磷酸化,如L型CaCn、KCn、SCn、ClCn、RyR、Pln、CRP的激活,但抑制TnnI。PKA磷酸化调节SERCA2活性的Pln,导致Ca2+、Cl-、K+、Na+的再摄取增加,这一过程在衰竭的心脏中受到影响。Ca2+摄取激活Caln,这进一步促进NFAT转运到细胞核,这是一个对轴突生长非常重要的过程。cAMP通过控制心肌收缩过程,在调节心血管功能中起重要作用。此外,Ca2+浓度的升高和PKA的激活通过丝氨酸残基(Ser635)的磷酸化增强eNOS酶的活性,从而刺激eNOS信号传导,这对维持心血管稳态至关重要。在心肌细胞中,肾上腺素通过β-ADR受体激活Gn-αs,导致ACs的激活和cAMP水平的升高,从而增强心肌收缩力和心率。这一机制是心血管系统如何响应应激状态的重要组成部分,确保机体在需要时能够提供足够的氧气和营养物质。在心肌细胞中,cAMP-PKA信号通路通过调节多种蛋白的磷酸化状态,精确控制心肌细胞的收缩和舒张过程,维持心脏的正常功能。
·在神经元中,cAMP信号通路参与学习和记忆的形成。cAMP通过EPACs激活Rap1,从而促进树突棘的形成和突触可塑性,这对于学习和记忆的形成具有重要意义。在神经元中,cAMP被发现能够激活EPACs,促进Rap1的激活,进而影响细胞的多种功能,如树突棘的形成和突触可塑性。这种机制在神经元中尤为重要,为学习和记忆的形成提供了分子基础。此外,cAMP还能够通过调控 CREB(cAMP反应元件结合蛋白)、CREM(cAMP反应元件调节因子)和ATF1(激活转录因子-1)的活性,影响基因表达,从而调节神经元的长期行为和功能。
·在免疫细胞中,cAMP信号通路调节细胞因子的产生和免疫反应。Urocortin-cAMP介导的PKC和p38的诱导导致凋亡和细胞因子(如IL-6)的产生,下游的Urocortin-cAMP途径在免疫反应和炎症过程中发挥重要作用。在免疫细胞中,cAMP通过调节mTOR和p70S6K的活性,影响细胞的生长和代谢,这种调控对于免疫系统的正常功能至关重要。此外,cAMP还能够通过抑制GSK3,保护神经元免受淀粉样蛋白的毒性作用,这在阿尔茨海默病中尤为重要。
·在哮喘患者中,cAMP水平的降低会导致气道平滑肌收缩,而β2-ADR激动剂可以通过激活Gn-αs和增加cAMP水平来缓解这一症状。具体而言,β2-ADR激动剂与气道平滑肌细胞表面的β2-ADR受体结合,激活Gn-αs,导致ACs的激活和cAMP水平的升高。升高的cAMP水平通过激活PKA,导致气道平滑肌松弛,缓解哮喘症状。这一机制是哮喘治疗的重要理论基础,为哮喘的药物治疗提供了依据。
·在胰岛素信号通路中,胰岛素通过激活PI3K-Akt信号通路,影响cAMP水平,从而调节葡萄糖代谢。胰岛素与细胞表面的胰岛素受体结合后,激活PI3K-Akt信号通路,进而影响cAMP水平。这种相互作用调节了心脏的收缩力和代谢能量的释放,展示了不同信号通路如何协同工作以实现特定的生理功能。此外,胰岛素还能够激活Src,通过Ras增强Raf1的激活。Raf1促进MEK1/2的激活,进而激活ERKs,最终诱导转录调节剂Elk1介导的基因表达。这种多层次的调控机制是cAMP信号通路功能多样性的基础,也是其在众多生理过程中发挥重要作用的关键所在。
·在肝脏中,cAMP通过激活PHK和PYG,促进糖原分解,增加血糖水平。Gcg结合到肝细胞表面,通过PKA介导的级联反应激活PHK,从而引发cAMP生成的增加,导致糖原溶解速率的增加。PHK进一步激活PYG,将糖原转化为葡萄糖-1-磷酸。然后磷酸葡萄糖脲酶将磷酸转移到葡萄糖-1-磷酸的C-6,产生葡萄糖-1,6-磷酸作为中间体。然后,C-1上的磷酸被转移到使其再生的酶上,葡萄糖-6-磷酸是进入糖酵解的释放产物,这和肝细胞对肾上腺素通过ADR-α/β释放的反应是一样的。PKA进一步抑制GYS,导致糖原合成等能量消耗过程的发作。这种调控机制确保了肝脏能够根据机体的需求,适时释放或储存糖原,维持血糖水平的稳定。
·在炎症反应中,cAMP通过失活Rho激酶,抑制细胞收缩,从而减轻组织损伤。在激素的刺激下,cAMP增加RhoA的磷酸化,使Rho激酶失活。Rho激酶通过抑制Myosin磷酸酶调控亚基PPtase1的催化活性,催化其磷酸化,从而间接增加RLC磷酸化,从而调控Myosin-II和细胞收缩。Rho激酶的失活也会直接增加RLC的磷酸化,这种增加的细胞内cAMP和PKA对RLC磷酸化的激活减少了凝血酶诱导的内皮细胞等长张力的发展,从而减少了水肿的发展,这是急性和慢性炎症的标志。这一机制为炎症的治疗提供了潜在的靶点,为开发针对炎症的药物提供了理论基础。
·在精子功能的调节中,cAMP扮演着重要角色。Ca2+和HCO3-在精子功能的调节中起着关键作用,最有可能是通过cAMP水平的调节。sAC在人类精子中很活跃,是HCO3-和Ca2+的传感器。Ca2+通过CaCn和CNG释放,激活Calm和CamKs,进一步激活Caln、CamK2和CamK4。这些反过来又通过调节ACs和PDE的活性来调节cAMP的产生,CamKs和Caln抑制PDE和ACIX,而CamK2和CamK4分别抑制ACIX和ACI的功能。ACIX也受到PKC的抑制,从而控制海马神经元中的cAMP信号。这种复杂的调控网络确保了精子能够对外部环境作出适当的反应,执行其生物学功能。
·在细胞周期调控中,cAMP信号通路通过调控多种分子的活性,影响细胞的增殖和分裂。PTP的失活导致ERKs的分离和随后的激活,PCTK1和APC的失活分别有助于维持细胞增殖和后期起始和后期有丝分裂事件的控制,从而检查降解细胞周期调节因子。这种调控机制确保了细胞周期的正常进行,防止细胞异常增殖或分裂,这对于维持机体的正常功能和防止疾病发生具有重要意义。
·在脂肪代谢中,cAMP通过激活PKA,促进脂解过程。PKA通过磷酸化白色脂肪组织中的HSL来增强细胞中储存能量的释放,从而导致甘油三酯的水解。HSL水解甘油三酯产生游离脂肪酸,这是释放储存能量的主要途径,这一过程被称为脂解。这种调控机制使机体能够在需要时释放储存的脂肪,提供能量,维持代谢平衡。
·在昼夜节律调控中,cAMP信号通路参与控制极化上皮细胞的胞吐事件,提示其在昼夜节律的时序调控中发挥作用。cAMP信号的异源致敏有助于基本的生理过程,如昼夜节律的时序、性行为和神经递质相互作用,也有助于神经系统疾病,如药物滥用和药物引起的运动障碍。这提供了洞察机制成瘾和许多其他中枢神经系统紊乱反映改变的神经元细胞功能的途径。此外,它也代表了ACs非常可能的作用,并为针对ACs的治疗开辟了途径,这可能在男性避孕药的开发中证明是有用的。
cAMP信号通路异常与主要疾病类别的关联:
1) 代谢性疾病
(1) 糖尿病:
·胰岛素抵抗: cAMP水平升高(如应激激素肾上腺素、胰高血糖素作用)会拮抗胰岛素信号通路,抑制葡萄糖摄取和利用,促进糖异生和肝糖输出,加剧高血糖。β2-肾上腺素能受体激动剂治疗哮喘可能升高血糖即与此相关。
·胰岛β细胞功能:适度cAMP信号(如GLP-1通过其受体激活AC)可刺激胰岛素分泌、促进β细胞增殖并抑制其凋亡,这是GLP-1受体激动剂(如利拉鲁肽、司美格鲁肽)治疗2型糖尿病的重要机制。然而,慢性或过度的cAMP刺激也可能导致β细胞衰竭。
(2) 肥胖: cAMP参与调节脂肪分解(脂解)。儿茶酚胺类激素通过激活脂肪细胞上的β-肾上腺素能受体升高cAMP,激活PKA,磷酸化脂肪酶和围脂滴蛋白,促进甘油三酯分解为游离脂肪酸。该通路功能障碍与脂肪代谢紊乱相关。PDE抑制剂(如咖啡因中的物质)能增强此过程。
2) 心血管疾病
(1) 心力衰竭:
·心肌收缩力调节: β1-肾上腺素能受体激活→cAMP↑→PKA激活→磷酸化L型钙通道、受磷蛋白、肌钙蛋白I等→增强心肌收缩力(正性肌力作用)和心率(正性变时作用)。在慢性心衰中,长期交感神经过度激活导致β受体脱敏(下调)、抑制性G蛋白(Gi)信号增强、AC活性降低、PDE活性增加等因素共同造成心肌细胞cAMP信号减弱及反应性下降(“β受体信号通路减敏”),是心肌收缩储备耗竭的核心机制之一。
·靶向PDE: PDE3抑制剂(如米力农)通过抑制cAMP降解,增强心肌收缩力和血管扩张,用于急性心衰治疗,但长期使用增加死亡率。PDE5抑制剂(如西地那非)主要作用于血管平滑肌,用于肺动脉高压和勃起功能障碍。
(2) 高血压: cAMP通过PKA磷酸化肌球蛋白轻链激酶,抑制其活性,导致血管平滑肌舒张。内皮素-1等缩血管物质可通过降低cAMP水平促进血管收缩。前列腺素(如前列环素PGI2)通过激活AC升高cAMP是其强大扩血管效应的基础。PDE5抑制剂也通过此机制降压。
(3) 心律失常: cAMP/PKA信号过度增强(如β受体过度刺激)可促进心脏起搏细胞的自律性,增加触发活动和折返风险,诱发室性心律失常(如儿茶酚胺敏感性室速)。PKA对钙通道和兰尼碱受体的调控异常也参与其中。
3) 神经系统疾病
(1) 阿尔茨海默病: cAMP/PKA/CREB信号通路在突触可塑性、长期记忆形成和神经元存活中至关重要。AD患者脑中该通路活性显著降低,与认知功能障碍相关。提高cAMP水平(如使用PDE4抑制剂)在动物模型中显示出神经保护和改善认知的潜力。
(2) 抑郁症:多种抗抑郁药(如单胺氧化酶抑制剂、选择性5-羟色胺再摄取抑制剂)最终通过增加突触间隙单胺类神经递质(如5-HT、NE)水平,激活其GPCR(如5-HT4/6/7, β-受体),升高神经元内cAMP,增强CREB介导的神经营养因子(如BDNF)表达,促进神经可塑性和神经发生,发挥治疗作用。慢性应激可损害该通路。
(3) 帕金森病: cAMP信号参与调控多巴胺能神经元的功能和存活。腺苷A2A受体拮抗剂(如伊曲茶碱)通过阻断抑制性A2A受体对AC的负调控,间接增强纹状体多巴胺D2受体信号通路(该通路降低cAMP),成为PD治疗的新策略。
(4) 疼痛:阿片类药物通过激活抑制性Gi/o偶联的阿片受体→抑制AC活性→降低cAMP水平→减少神经递质释放和神经元兴奋性→产生镇痛。长期使用导致cAMP信号代偿性上调(AC超活化)是阿片耐受和戒断症状的重要机制。
4) 感染性疾病
(1) 细菌毒素作用机制:
·霍乱毒素:不可逆激活Gs蛋白→持续激活AC→肠道上皮细胞cAMP急剧升高→过度激活CFTR氯离子通道→大量氯离子和水分泌入肠腔→严重水样腹泻。
·百日咳毒素:不可逆激活Gi蛋白→抑制AC→降低免疫细胞(如巨噬细胞、中性粒细胞)cAMP水平→影响其趋化、吞噬等功能→利于细菌免疫逃逸。
(2) 免疫调节: cAMP是重要的免疫抑制信号。高水平cAMP抑制T细胞活化、增殖和细胞因子产生,抑制巨噬细胞炎症反应(如TNF-α产生)。调节性T细胞(Treg)可通过产生cAMP抑制效应T细胞。肿瘤微环境或某些病原体感染可能利用此机制进行免疫抑制。
5) 肿瘤
cAMP在肿瘤中的作用具有高度组织特异性和背景依赖性,既可抑制也可促进肿瘤发生发展。
(1) 肿瘤抑制作用:
·在某些类型肿瘤(如甲状腺癌、嗜铬细胞瘤、神经内分泌肿瘤)中,cAMP/PKA信号可抑制细胞增殖、诱导分化或凋亡。
·激活Gs偶联受体或AC可抑制部分乳腺癌、前列腺癌、结肠癌细胞生长。
·PKA磷酸化CREB可调控抑癌基因表达。
(2) 肿瘤促进作用:
·在另一些肿瘤(如皮肤基底细胞癌、某些白血病)中,cAMP信号(尤其是通过Epac)可能促进细胞增殖、存活、迁移或侵袭。
·cAMP可通过PKA磷酸化Rap1GAP抑制抑癌基因Rap1活性。
·肿瘤微环境中高水平cAMP可抑制抗肿瘤免疫应答。
(3) 靶向治疗:基于cAMP通路的特异性靶点(如特定AC亚型、PDE亚型、PKA亚型、Epac)开发药物是肿瘤研究热点。PDE抑制剂在特定肿瘤(如黑色素瘤)中显示出疗效。
6) 其他疾病
(1) 囊性纤维化: CFTR氯离子通道基因突变是其根本原因。CFTR功能上受PKA磷酸化调控(cAMP激活PKA)。即使存在功能性CFTR蛋白,cAMP信号不足也会影响其功能。PDE抑制剂理论上可增强残留CFTR功能,但主要治疗手段是CFTR蛋白矫正剂(如依伐卡托)。
(2) 骨质疏松:甲状旁腺激素通过激活Gs偶联受体→升高成骨细胞内cAMP→促进骨形成。特立帕肽(重组人PTH片段)即利用此机制治疗严重骨质疏松。
(3) 哮喘/慢性阻塞性肺疾病: β2-肾上腺素能受体激动剂(如沙丁胺醇)→激活Gs→升高气道平滑肌cAMP→舒张支气管。PDE4抑制剂(如罗氟司特)通过抑制炎症细胞(如中性粒细胞、巨噬细胞)内cAMP降解,发挥抗炎作用,用于COPD和哮喘。
05结论与展望
cAMP信号通路作为细胞内最古老且功能最为多样的第二信使系统之一,在细胞对外部环境的感知和响应中扮演着至关重要的角色。通过本文的系统探讨,我们可以看到cAMP信号通路从分子基础到生理功能的多层次调控机制,以及其在各种生理和病理状态下的重要作用。这种复杂的信号通路不仅为细胞提供了精细调控其内部活动的手段,也为多种疾病的治疗策略提供了理论基础和潜在靶点。
cAMP信号通路的核心在于其独特的分子组成和精确的调控机制。ATP向cAMP的转化过程由多种AC催化,而cAMP的降解则主要由PDE家族成员介导。这种动态平衡确保了细胞内cAMP水平能够根据外部信号和内部状态进行精确调整,从而调控各种生理过程。tmAC和sAC在调控机制上存在显著差异,前者主要通过G蛋白调控,后者则直接被Ca2+和HCO3-激活,这种差异化的调控机制使细胞能够根据特定的生理需求和环境信号产生特定的反应。此外,tmAC家族中的不同成员(I至IX)在分布、调控特性和功能上存在显著差异,这种多样性为细胞提供了精细调控cAMP水平的分子基础,使得不同类型的细胞能够根据特定的生理需求和环境信号调整其cAMP信号通路的活性。
cAMP信号通路通过多种靶点调控广泛的细胞功能,从代谢调节到基因表达,从神经传递到免疫反应。PKA作为cAMP最主要的下游效应器,通过磷酸化多种底物,影响细胞的多种功能。EPACs是近年来发现的cAMP新靶点,它们通过Rap1/Rap2小G蛋白调控多种细胞功能。CNG是cAMP的另一重要靶点,cAMP激活CNG为Ca2+内流提供通道,这种钙离子内流对于细胞的各种功能至关重要。此外,cAMP还能够激活mTOR和p70S6K,促进细胞生长,同时增强PLA2的活性,促进储存能量的释放。这种多样化的靶点确保了cAMP信号通路能够调控广泛的细胞功能,为细胞提供了精细调控其内部活动的手段。
cAMP信号通路在众多生理过程中发挥着关键作用,从心脏功能到神经元信号传递,从免疫反应到代谢调节。在心血管系统中,cAMP信号通路通过调节PKA的活性,控制心肌收缩力和心率。在神经元中,cAMP信号通路参与学习和记忆的形成。在免疫细胞中,cAMP信号通路调节细胞因子的产生和免疫反应。在哮喘患者中,cAMP水平的降低会导致气道平滑肌收缩,而β2-ADR激动剂可以通过激活Gn-αs和增加cAMP水平来缓解这一症状。在肝脏中,cAMP通过激活PHK和PYG,促进糖原分解,增加血糖水平。在炎症反应中,cAMP通过失活Rho激酶,抑制细胞收缩,从而减轻组织损伤。这种多样化的生理功能反映了cAMP信号通路的重要性,也为其在多种疾病的治疗中提供了潜在的靶点。
cAMP信号通路的失调与多种疾病的发生和发展密切相关,理解这一信号通路在疾病中的作用不仅有助于揭示疾病的分子机制,也为开发针对这些疾病的治疗策略提供了理论基础。在哮喘中,β2-ADR受体功能受损导致cAMP水平降低,气道平滑肌收缩增强,而β2-ADR激动剂通过增加cAMP水平来缓解这一症状。在神经退行性疾病中,如阿尔茨海默病,cAMP信号通路的异常与疾病的发生和发展密切相关,通过抑制GSK3,cAMP信号通路可以保护神经元免受淀粉样蛋白的毒性作用。在心血管疾病中,cAMP-PKA信号通路的失调可能导致心功能下降,表现为心力衰竭等病理状态。在免疫系统疾病中,cAMP信号通路的异常也与多种病理状态相关,针对cAMP信号通路的治疗策略可能对自身免疫性疾病和免疫缺陷病具有潜在的治疗价值。在炎症性疾病中,cAMP通过失活Rho激酶,抑制细胞收缩,从而减轻组织损伤,这一机制为炎症的治疗提供了潜在的靶点。在代谢性疾病中,cAMP信号通路的异常也与疾病的进展密切相关,针对cAMP信号通路的治疗策略可能对糖尿病等代谢性疾病具有潜在的治疗价值。在癌症中,cAMP信号通路的异常与肿瘤的发生和发展密切相关,针对cAMP信号通路的治疗策略可能对癌症具有潜在的治疗价值。
尽管我们对cAMP信号通路有了较为深入的理解,但这一领域仍有许多问题需要进一步研究。首先,cAMP信号通路的时空动态调控机制仍有许多未解之谜,特别是在不同细胞类型和状态下的特异性调控机制。其次,cAMP信号通路与其他信号通路的交叉对话和协同作用需要更深入的研究,以揭示信号网络的复杂性和整体调控机制。此外,cAMP信号通路在各种生理和病理状态下的具体功能和调控机制也需要进一步探讨,以更好地理解其在维持生命活动中的核心地位。最后,基于cAMP信号通路的治疗策略的开发和优化也是一个重要的研究方向,特别是在提高药物的特异性、有效性和降低副作用方面。
总的来说,cAMP信号通路作为一个古老而功能多样的信号系统,在细胞信号传导领域占据着重要地位。它不仅为第二信使的概念提供了范式,也揭示了信号区隔的精妙机制。未来的研究应该致力于深入理解这一信号通路的分子机制和生理功能,为开发针对各种疾病的治疗策略提供理论基础和潜在靶点,从而更好地服务于人类健康和疾病防治。





